ید، [۷۵۵۳-۵۶-۲] با جرم اتمی ۱۲۶.۹۰۴۴، عدد اتمی ۵۳، عنصری غیر فلزی از خانواده هالوژنهاست که در گروه VII A جدول تناوبی بین برم و استاتین قرار دارد.
آرایش الکترونی اتم ید بصورت Kr] 4d10 5s2 5p5] است.جرم اتمی نسبی پایدار ید فقط ایزوتوپ ۱۲۷ است. تاکنون ۲۲ ایزوتوپ مصنوعی برای ید تهیه شده است که جرمی بین ۱۱۷ تا ۱۳۹ دارند و ۱۴ مورد از اینها راندمان پرتوزایی مهمی را دارند، I122 تا I123 و I126 تا I136 .
کوتاهترین نیمه عمر مربوط به ایزوتوپ I136 با نیمه عمر ۸۶ s و بلندترین نیمه عمر مربوط به ایزوتوپ I129 با نیمه عمر۱.۶×107a است. ایزوتوپ I129 محصول شکافت U235 با نوترون آرام است.بدلیل استفاده آنها در کار ردیابی رادیواکتیو و رادیوتراپی(پرتو درمانی)، مهمترین رادیوایزوتوپها I131 با نیمه عمر 8d و I125 با نیمه عمر 60d میباشند.
تاریخچه کشف یـد:
ید برای اولین با در سال ۱۸۱۱ توسط برنارد کورتیوس(Bernard Courtois)] [۱۷۷۷-۱۸۳۸ در فرانسه کشف گردید. یـد هم مانند بسیاری از ترکیبات دیگر بصورت اتفاقی کشف گردید. در آن زمان ارتش ناپلئون برای تهیه باروت نیاز به مقدار زیادی پتاسیم نیترات (Saltpeter) داشت. پتاسیم نیترات یکی از ترکیبات اصلی باروت بود و برای تولید آن نیاز به منبع عظیمی از سدیم کربنات بود. سدیم کربنات را از خاکستر چوب تهیه میکردند اما جنگ به درازا کشید و چوب درخت بید که از آن برای تهیه سدیم کربنات استفاده میشد، تمام شد. در این بین پیشنهاد گردید که از خاکستر جلبک دریایی برای اینکار استفاده شود که منابع بزرگی از آن در سواحل نورماندی و بریتانیا وجود داشت. این پیشنهاد مورد قبول واقع شد.
در این پروسه جدید مقدار زیادی ترکیبات گوگردی مزاحم بوجود می آمدند که ظروف کار را آلوده میکردند. برای تمیز کردن آنها از اسید سولفوریک استفاده میشد. یکروز کورتیوس ناخواسته مقدار بیشتری اسید برای تمیز کردن خمره پتاسیم نیترات خود، بکار برد.
ناگهان یک بخار بنفش رنگی به هوا برخواست که این بخار بنفش پس از تماس با یک لوله سرد به فرم کریستالی براق تبدیل شد.
او تعدادی آزمایش ساده روی آن انجام داد و متوجه شد که این ماده با فسفر، هیدروژن و برخی فلزات بخوبی ترکیب میشود ولی با اکسیژن و کربن به راحتی ترکیب نمیشود. بعلاوه او کشف کرد که وقتی این ماده با آمونیاک ترکیب گردد یک ماده کاملا قابل انفجار بوجود می آید و در اثر حرارت تجزیه نمیشود.
کورتیوس نمیدانست که این ماده یک عنصر جدید است یا خیر و با تشدید جنگ او دیگر فرصت کافی برای تحقیق بیشتر روی این ماده نداشت. به همین منظور مقداری از این ماده مجهول را به دیگر دانشمندان مانند چارلز- برنارد دسورمز Désormes (1777-1862) ، نیکولاس کلمنت Nicolas Clément 1779-1841، گیلوساکGay-Lussac (1778-1850) و آندره آمپر André Ampère ارسال کرد.
در ابتدا گیلوساک و آمپر این ماده را ترکیبی اکسیژندار معرفی کردند. اما هنوز مطمئن نبودند تا زمانیکه همفری دیوی و جوزف گیلوساک آزمایشاتی روی این ماده انجام دادند. در دهم دسامبر۱۸۱۳ مقاله ای را انتشار داد که در آن اظهار داشت که آن یک ماده جدید بوده و از نظر خواص و ویژگیها بسیار شبیه به کلر و فلوئور است و آنرا Iodine که برگرفته از کلمه یونانی ioeides به معنای رنگ بنفش است نام نهاد و در مشاجره بر سر کاشف یـد، گیلوساک و دیوی، برنارد کورتیوس را کاشف این عنصر جدید اعلام کردند.
اولین ترکیب معدنی یـد دار () در سال ۱۸۲۵ در مکزیک کشف گردید و کشف یدات در سال ۱۸۴۰ در شیلی اتفاق افتاد.
ایجاد رنگ آبی در واکنش یـد با نشاسته در سال ۱۸۱۴توسط جی.جی کالین کشف گردید. او نشان داد که به کمک این پدیده میتوان یـد را در نسبت یک به ۴۰۰۰۰۰ تعیین مقدار کرد. در اواسط قرن ۱۸۰۰ Jean Boussingault فرانسوی برای اولین بار پیشنهاد کرد که از ترکیبات یـددار برای درمان گواتر استفاده گردد. شیمیدان آلمانی بنام Eugen Baumann(1846-1896) کشف کرد که غده تیروئید سرشار از یـد است.
خواص فیزیکی:
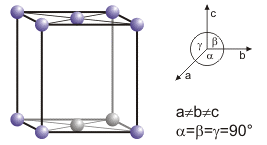
یـد اولین عضوی از خانواده هالوژنهاست که در دمای معمولی بصورت جامد است. بخار ید در فشار پایین فلورسانس از خود نشان میدهد و وقتی بوسیله نور خورشید یا نور قوس الکتریکی روشن میشود نوری به رنگ سبز مایل به زرد از خود ساطع میکند. همچنین وقتی در میدان مغناطیسی بین منشور صلیبی(ضربدری) نیکل و ترمولومینسانت (Thermoluminescent) بالای ۵۰۰ درجه سانتیگراد قرار میگیرد نور پلاریزه را میچرخاند. جذب اشعه ایکس یـد اندازه گیری شده و مشخص شد در ساختار اورتورومبیک تبلور پیدا میکند.
Crystal structure:base-centered orthorhombic
Unit-cell dimensions / pm:a=726.47, b=478.57, c=979.08
برخی از خواص فیزیکی یـد عبارتند از :
جدول زیر حلالیت یـد در آب و حلالهای آلی وبه همراه رنگ آنها را نشان میدهد :
حلالیت یـد در آب در دماهای مختلف:
| Temperature, 0C | Solubility, g/kg | Temperature, 0C | Solubility, g/kg |
| ۰ | ۰.۱۶۲ | ۶۰ | ۱.۰۶ |
| ۲۰
۲۵ |
۰.۲۹۳
۰.۳۴۰ |
۷۰
۸۰ |
۱.۵۱
۲.۱۷ |
| ۳۰ | ۰.۳۹۹ | ۹۰ | ۳.۱۲ |
| ۴۰ | ۰.۵۴۹ | ۱۰۰ | ۴.۴۸ |
| ۵۰ | ۰.۷۶۹ | ۱۱۰ | ۶.۶۵ |
خواص شیمیایی:
حالتهای اکسایش معمول یـد به ترتیب تمایل برابر است با: ۱- ۱+ ۳+ ۵+ ۷+
اما حالت اکسایش ۴+ نیز در ترکیبی مانند دیده شده است. همچنین یـد در بین هالوژنها از نظر الکترونگاتیویته در رتبه آخر قرار دارد و شدت واکنش آن در مقایسه با فلوئور، کلر و برم کمتر است. همچنین خواص اکسیداسیونی ملایمی از خود در برابر اسیدها نشان میدهد.
قدرت اکسید کنندگی یـد از استاتین پنجمین عنصر از گروه هالوژنها، بیشتر است.واکنش مشخصه هالوژنها در واکنش مستقیم آنها با فلز است که شدت این واکنش در یـد در مقایسه با دیگر هالوژنها کمتر است که منجر به تشکیل یک جامد غیر فرار میگردد.
یـد در حالت جامد یا بخار با مس، نقره، منیزیم، کلسیم، آلومینیوم، روی، قلع، نیکل و آهن واکنش داده و یـدیـدهای مربوطه را بوجود می آورد. ولی با سرب، بیسموت یا طلا واکنشی انجام نمیدهد. با پلاتین در دمای معمولی واکنش نمیکند ولی در دمای 14000C به راحتی واکنش داده و و میدهد. یـد با تنگستن در دمای معمولی واکنش میدهد ولی در دمای بالا خیر. همچنین با تانتال و نیوبیوم در دمای ۱۳۰۰-15000C واکنش داده و پنتایـدیـدهای مربوطه را میدهد. واکنش یـد با وانادیوم منجر به تولید میشود که در اثر حرارت به تجزیه میگردد.
بخار مرطوب یـد اثر خورندگی بر روی فلزات و انواع استنلس استیل را دارد. شروع این خوردگی با ایجاد یک مرکز یـدیـد فلز است و سپس بصورت الکتروشیمیایی خوردگی ادامه پیدا میکند. فقط استیلهای مولیبدن و تیتانیوم از اثر یـد در امان هستند.
ید با گازهای نجیب، گوگرد و سلنیوم واکنش انجام نمیدهد. از طرفی با برخی عناصر بطور مستقیم واکنش انجام میدهد مانند: کربن،نیتروژن، اکسیژن و برخی فلزات بی اثر. برخلاف کلر، ید با مونوکسید کربن،نیتریک اکسید یا دی اکسید گوگرد واکنش نمیدهد.
واکنش یـد با مونوکسید کربن فقط تحت شرایط اسیدی و کاتالیزور نمکهای پالادیوم امکانپذیر است. واکنش بخار فسفر و یـد منجر به ایجاد میگردد. یـد در سولفوریک اسید غلیظ بدون انجام واکنشی حل میشود ولی در نیتریک اسید غلیظ به پنتااکسید یـد تبدیل میشود.
واکنش هیدرولیز یـد بصورت زیر است:
ثابت تعادل برای واکنش فوق در دمای 250C برابر ۵.۴×۱۰-۱۳ است. غلظت ترکیبات طرف دوم واکنش وابسته به است. هرچه بیشتر شود مقادیر طرف دوم واکنش بیشتر میشود بطور مثال در تقریبا ۹۹% داریم ولی در تقریبا ۱۲% یـد و ۸۸% داریم. ثابت تفکیک برابر ۲.۳ ×۱۰-۱۱ بوده و تاثیر کمی در تشکیل یون دارد.
در محلول اسیدی، یـد یک اکسید کننده ضعیفی است. پتانسیل احیاء در 250C برابر ۰.۵۳۴- V است.یـد به سهولت تیوسولفات را به تتراتیونات اکسید میکند:
بطور مشابه یونهای و را در محلول اسیدی به و تبدیل میکند.
در محلولهای رقیق آبی، یـد دی اکسید گوگرد را به سولفوریک اسید اکسید میکند.
” تعیین درصد خلوص یـد بر طبق متد USP ”
خلوص یـد طبق استاندارد USP نباید کمتر از ۹۹.۸۰% و بیشتر از ۱۰۰.۵% باشد.
باقیمانده غیر فرار:
۵ گرم ید را در یک دیش چینی وزن نموده و وزن دقیق آنرا یادداشت کنید. سپس آنرا زیر هود، در حمام آب قرار دهید تا تمام ید بخار گردد. پس از اتمام این مرحله دیش را به مدت یکساعت در داخل اون تحت دمای ۱۰۵ درجه سانتیگراد قرار دهید.
سپس آنرا در داخل دسیکاتور بگذارید. پس از آنکه به دمای محیط رسید آنرا وزن کنید. باقیمانده نباید بیش از ۰.۰۵ درصد وزن اولیه باشد.
کلرید و برومید:
۲۵۰ میلیگرم ید کاملا پودر شده را وزن نموده و ۱۰ میلی لیتر آب مقطر به آن اضافه کنید. آنرا فیلتر کرده و به محلول زیر صافی قطره قطره سولفوروس اسید رقیق (حدودا ۱%) را تا زمانی اضافه کنید که محلول بیرنگ گردد.
به محلول، ۵ میلی لیتر آمونیاک ۶ نرمال اضافه نموده و سپس ۵ میلی لیتر نیترات نقره ۰.۱ نرمال را قطره قطره و به آرامی اضافه کنید. حاصل را فیلتر نموده و محلول زیر صافی را با نیتریک اسید، اسیدی نمایید. کدورت محلول حاصل نباید از کدورت محلولی باشد که تحت شرایط و واکنشگرهای یکسان از ۰.۱ میلی لیتر کلریدریک اسید ۰.۰۲ نرمال تهیه شده باشد که البته سولفوروس اسید(H2SO3) از آن حذف شده است.
تعیین درصد خلوص یـد:
در یک بشر کوچک ۱ گرم پتاسیم یدید را در ۵ میلی لیتر آب حل کنید سپس حدود ۵۰۰ میلیگرم ید کاملا پودر شده را در یک ارلن دربدار وزن کرده و وزن دقیق آنرا یادداشت کنید.
محلول پتاسیم یدید را به ید اضافه نموده و درب بالن را ببندید. کمی تکان دهید تا ید کاملا حل گردد. پس از انحلال کامل ۵۰ میلی لیتر آب مقطر و ۱ میلی لیتر اسید کلریدریک ۳ نرمال اضافه نمایید. حاصل را با محلول استاندارد شده سدیم تیوسولفات ۰.۱ نرمال تیتر کنید. در نزدیکی نقطه پایانی زمانیکه رنگ محلول ید زرد کاهی شد ۳ میلی لیتر شناساگر چسب نشاسته اضافه کنید. رنگ محلول آبی تیره خواهد شد. تا بیرنگ شدن محلول تیتر را ادامه دهید.
محاسبه:
هر میلی لیتر محلول سدیم تیوسولفات ۰.۱ نرمال با ۱۲.۶۹ از ید هم ارز است.
سم شناسی و بهاشت حرفه ای
یـد بوسیله بدن جذب میشود و به فرم دی یـدوتیروزین و تری یـدوتیرونین انباشته میشود. یـد برای انسان و دیگرجانداران بزرگ یک ماده ضروری است. یک شخص در حالت عادی نیاز به ۷۵ میلیگرم ید در سال دارد. که میتواند توسط نمکهای یـددار تامین گردد.
یـد در دمای معمولی مقایسه با دیگر هالوژنها از ایمنی بالاتری برخوردار است. زیرا یـد جامد بوده و فشار بخار آن فقط ۱ kPa
(۷.۵ mmHg) در دمای ۲۵ درجه سانتیگراد است در صورتیکه این مقدار برای برم و کلر به ترتیب برابر ۲۸.۷ kPa و ۷۰۰ kPa است.
انجمن بهداشت و ایمنی حرفه ای امریکا( OSHA) ماکزیمم مقدار غلظت بخار یـد مجاز در هوای محیط کار را ۰.۱ ppm تعیین نموده است.اگر بخواهید یـد را با دست لمس کنید توصیه میشود حتما از دستکش و پیشبند پلاستیکی و عینک محافظ و ماسک استفاده کنید. حداکثر مقدار ممکن از یـد برای قرار گرفتن در معرض آن در یک ساعت، ۰.۱ ppm است. در معرض قرار گرفتن ریه و چشمها در برابر ۰.۱ ppm یـد میتواند باعث سوزش این اعضاء گردد.
قرار گرفتن در معرض بیش از ۰.۱ ppm در طی دوره های زیاد میتواند باعث سوزش شدید چشمها و بخشهای تنفسی و ورمهای ریوی گردد.دز مرگ آور برای یک فرد بزرگسال بین ۲ تا ۴ گرم است. طولانی کردن تماس یـد با پوست میتواند بسیار مضر و باعث سوختگی گردد. آستانه تشخیص بوی یـد برای انسان برابر ۰.۹ ppm میباشد.
اثرات مزمن قرار گرفتن در معرض یـد: بی خوابی، آماس ملتحمه، التهاب مخاط بینی، برونشیت، رعشه، افزایش ضربان قلب، اسهال و کاهش وزن.
ظروف خالی یـد را باید در کوره ها سوزاند یا با محلول رقیق تیوسولفات یا تیو سولفیت خنثی کرد.
اگر چشمها بخاطر تماس با یـد سوزش پیدا کرد باید با آب شستشو داده شود. برای الودگی پوست میتوان از محلول تیوسولفات ۵% استفاده کرد.اگر یـد بلعیده شود، شخص را وادار به استفراغ کرده و معده باید بلافاصله با تیوسولفات ۵% شستشو داده شود سپس مصدوم به بیمارستان منتقل گردد. اگر مصدم بیهوش شده باشد چیزی به وی نخورانید.
اگر شخص در اثر آلودگی با یـد دچار مشکلات شدید ریوی شد باید مصدوم را به هوای آزاد انتقال داد. اگر برای مصدوم تنفس به راحتی امکان نداشت از کپسول اکسیژن استفاده کنید و درصورت قطع شدن تنفس از تنفس مصنوعی را انجام دهید.
یـد میتواند در یک با محلول آمونیاک در حضور یک ماده فعال آلی مخلوط گردد. گرچه تماس گاز آمونیاک و محلول آن با یـد آزاد و مشتقهای هالوژن آن در هر فرمی میتواند منجر به تشکیل ماده قابل انفجار نیتروژن تری یـدیـد(NI3)گردد. اگر رنگ قهوه ای تیره آن به جامد سیاه رنگ تبدیل شد تا زمانیکه مرطوب است باید دور ریخته شود یا روی آن یک مایع احیاءکننده مانند اتانل یا هر ماده ایکه میتواند یـدینه شود (یـد دار) ریخته شود.
یـدیـدها وقتی سمی هستند که مقدار آنها زیاد باشد. خوردن یا جذب شدن آنها از پوست باعث یـدیسم میگردد. که با بروز دانه و جوش، آبریزش بینی یا سردرد خود را نشان میدهد. در موارد شدید ممکن است باعث ضعف و سستی، کم خونی و افسردگی گردد.
در تماس با ترکیبات آلی یـد حتما دقت لازم را داشت.
در سال ۱۹۷۹ و ۱۹۸۶ حوادث هسته ای منجر به آزاد شدن یـد رادیواکتیو 131I به اتمسفرگردید. خوردن پتاسیم یـدیـد بلافاصله پس از آلودگی با این یـد رادیواکتیو میتواند مقدار تابش رادیواکتیو را در غده تیروئید تا بیش از ۹۰% کاهش دهد. برای بزرگسالان مقدار ۱۳۰ mg توصیه شده است. اگر از مدت آلودگی ۴ ساعت بگذرد پتاسیم یـدیـد فقط تا ۵۰% از آلودگی را میتواند کاهش دهد.